藥典無菌檢查用培養基適用性檢查記錄 需要包含哪些內容?
發布時間:2024-07-11 瀏覽次數:1342
最近小編收到不少藥品企業的咨詢,詢問培養基適用性檢查記錄表格該如何設計,應該包含哪些內容,小編今天就大家密切關切的這一問題,進行設計分享。本次設計充分考慮到檢驗員繁重的工作量問題,本著操作記錄可追溯,書寫去繁化簡的原則,同時充分考慮到2025版培養基驗收部分的變化,小試牛刀,先對無菌檢查用培養基適用性表格進行了設計,設計僅代表個人思路,不具有權威性,如有不同意見,可以留言區參與討論。
藥典無菌檢查法用培養基適用性檢查記錄
一、基本信息:

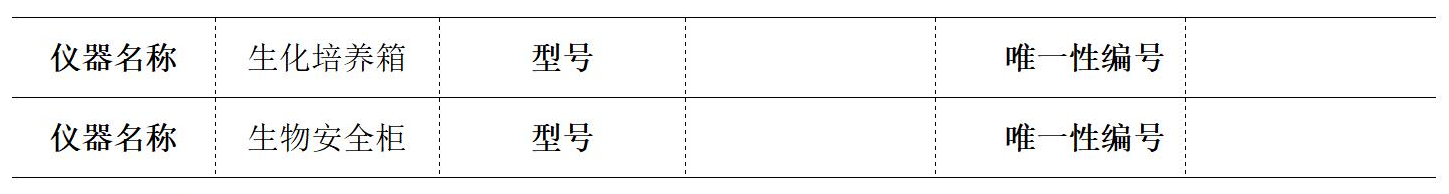
二、所用關鍵儀器設備:
三、 檢驗方法:
1、無菌性檢查
每批培養基一般隨機取不少于5支(瓶)部分培養基,置各培養基規定的溫度培養14天,定期觀察結果。——2025版《中國藥典》1101公示稿
2、靈敏度檢查
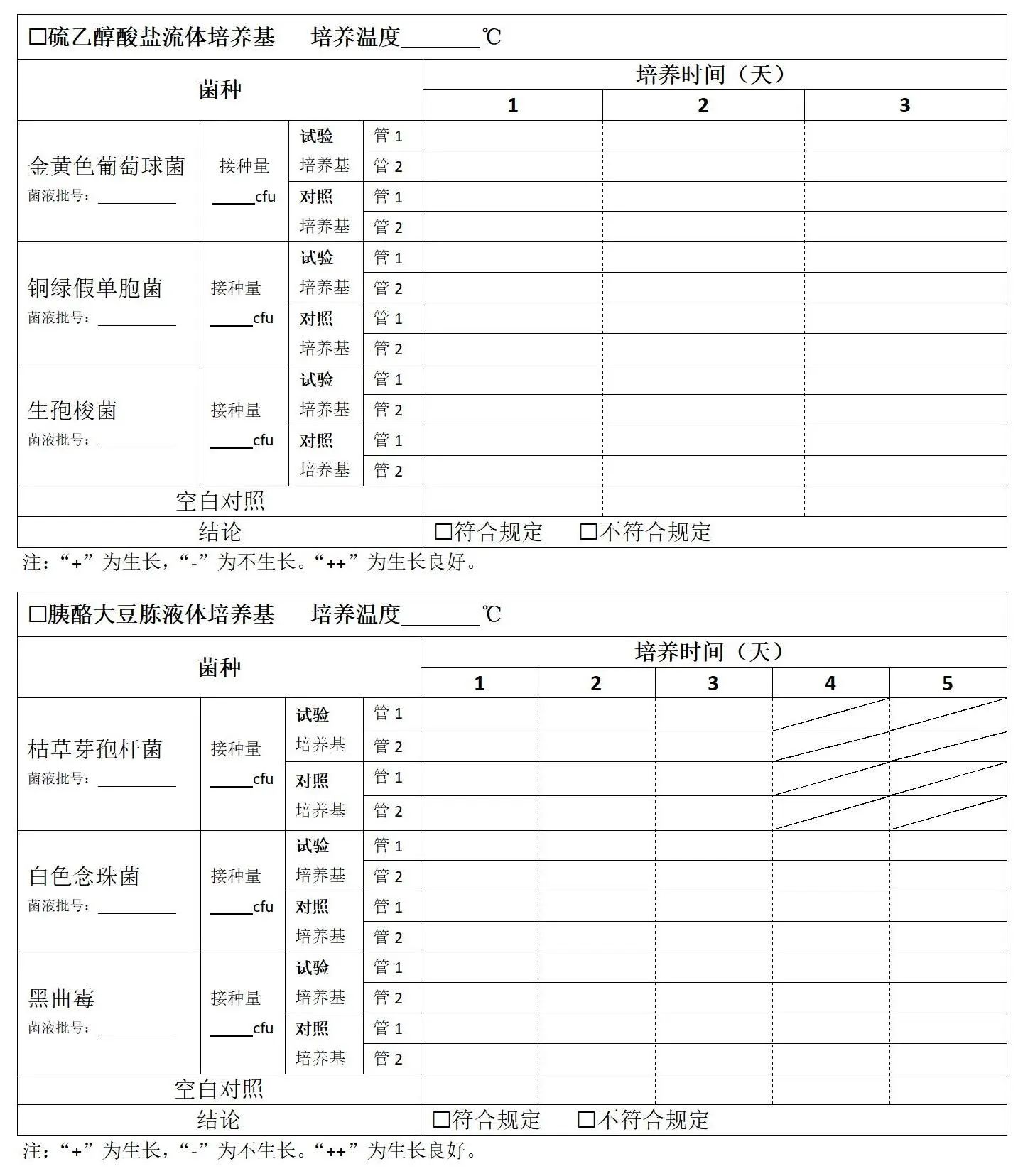
□ 硫乙醇酸鹽流體培養基:取 mL的硫乙醇酸鹽流體培養基7支,分別接種不大于100cfu的金黃色葡萄球菌、銅綠假單胞菌、生孢梭菌各2支,另一支不接種作為空白對照,于30~35℃培養3天,培養時段內,定期觀察結果。
□ 胰酪大豆胨液體培養基:取 mL的胰酪大豆胨液體培養基7支,分別接種不大于100cfu的枯草芽孢桿菌、白色念珠菌、黑曲霉各2支,另一支不接種作為空白對照,與20~25℃培養,接種枯草芽孢桿菌的培養管不超過3天,接種白色念珠菌、黑曲霉的培養管5天,培養時段內,定期觀察結果。
四、檢驗結果:
□ 培養基的無菌性檢驗【第 次】
培養溫度: ℃,起始培養時間 年 月 日
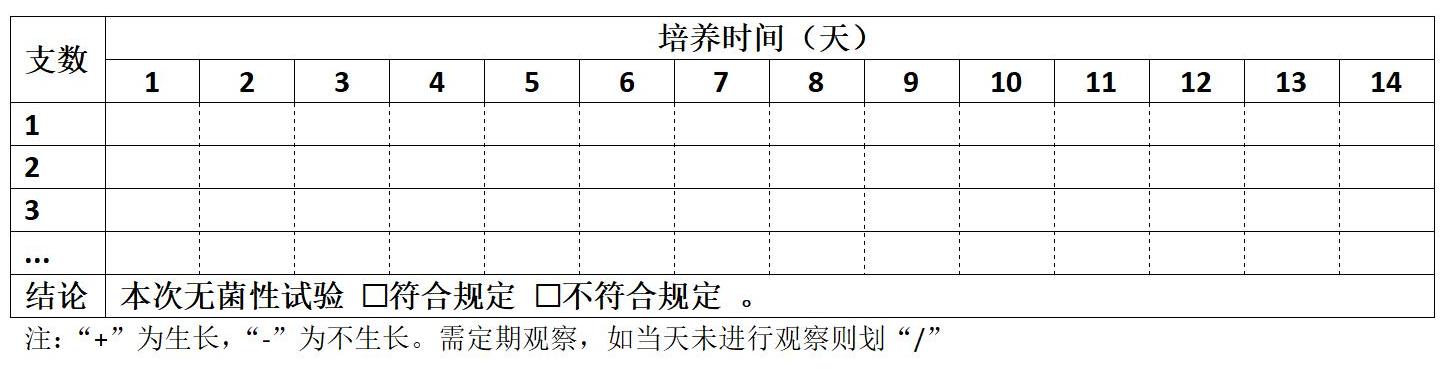
說明:2025版藥典1101公示稿中,要求每批次培養基取部分培養,可在供試品檢查時將培養基空白對照作為該批次培養基無菌性檢查的組成部分。不局限于首次做5支培養。
□ 培養基的靈敏度檢查
五、結論:
本品 (培養基名稱) 批次(配制批次/成品試劑批次)按照 (標準名稱)進行檢驗,結果 □ 符合規定 □ 不符合規定。
檢驗人: 檢驗時間: 復核人: 復核日期:





