導讀:人類諾如病毒是引發急性胃腸炎的主要病原體,具有高度傳染性。近年來,科學家發現諾如病毒不僅以單體形式存在,還可被細胞囊泡包裹,形成多病毒簇(viral vesicles)。這種結構不僅增強了病毒的感染性,還顯著提高了其對常規消毒處理的抵抗能力。本文以小鼠諾如病毒為模型,系統研究了三種過氧類消毒劑對囊泡包裹病毒的滅活效果,并揭示囊泡結構對病毒的“屏障保護”機制。研究發現,電中性的過氧乙酸(PAA)在中性pH下可有效滅活病毒囊泡,而帶負電荷的過氧乙酸離子(PAA?)和過氧單硫酸鹽(PMS?)滅活效果顯著受限。這一差異揭示了囊泡膜在阻止帶電消毒劑擴散中的關鍵作用,并提示我們未來在病毒控制策略中需考慮囊泡結構帶來的挑戰。
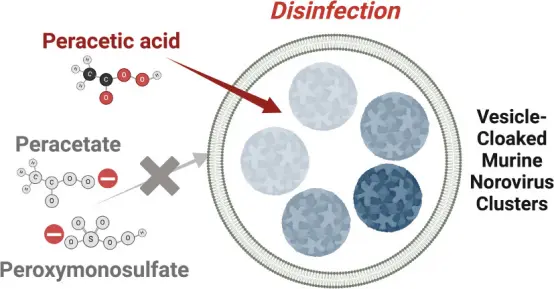
病毒囊泡對消毒劑形成“屏障”,影響滅活效率
以小鼠諾如病毒(MNV-1)為替代模型,評估了三種不同形式的過氧類消毒劑(PAA、PAA? 和 PMS?)在中性或堿性條件下的消毒效果。結果顯示,三種消毒劑均能快速有效滅活游離病毒顆粒,表現出相似的一級反應速率常數(0.23–0.28 min?1)。但對于囊泡包裹的病毒簇,僅電中性的PAA表現出可比游離病毒的滅活效果(0.25 min?1),而PAA?與PMS?的滅活速率大幅降低,分別下降至0.15和0.11 min?1。更重要的是,當囊泡被破壞并釋放出“躲藏”在其中的病毒后,再次評估其感染力發現,PAA仍能有效滅活,但PAA?和PMS?幾乎無法滅活這些囊泡內釋放的病毒,滅活速率分別下降至0.015和0.11 min?1。這表明囊泡結構不僅能保護病毒免于直接滅活,還可阻斷帶電消毒劑的穿透,是病毒對環境消毒抗性的關鍵來源。
消毒主要損傷囊泡蛋白質而非病毒基因或結構
通過蛋白定量分析和Western Blot檢測,發現過氧類消毒劑對病毒及囊泡的蛋白質造成顯著氧化損傷,尤其是含硫氨基酸如甲硫氨酸(Met)和半胱氨酸(Cys)易被氧化,而這類氧化可破壞病毒關鍵結構蛋白如VP1。與之相比,病毒的ORF2基因片段在高濃度消毒劑處理下保持完整,提示消毒主要通過破壞蛋白質功能而非直接降解核酸。此外,免疫磁分離與納米粒徑分析表明,囊泡整體結構在過氧消毒劑處理下仍相對完整,囊泡數量和尺寸未發生明顯變化。這進一步說明,囊泡作為“保護殼”,即使外部環境受到強氧化攻擊,也可維持病毒結構和部分功能的穩定。
囊泡影響病毒生命周期的關鍵環節是“內化”
病毒感染細胞需經歷“結合”和“內化”兩個步驟。研究發現,三種過氧類消毒劑對病毒(包括囊泡包裹的形式)與細胞膜的結合能力影響極小,但對內化過程影響顯著。統計分析表明,囊泡病毒的內化速率常數在PAA處理下為0.07 min?1,而游離病毒僅為0.027 min?1。PMS?和PAA?也展現出類似趨勢。這說明消毒過程雖未影響病毒與細胞的初步接觸,但顯著干擾了病毒通過內吞進入細胞的關鍵步驟。而內化能力的受損將嚴重限制病毒的復制與感染能力,是消毒劑介導滅活的主要機制之一。此外,研究還發現囊泡病毒比游離病毒具有更高的感染效率,可能與囊泡中多粒子“群體入侵”導致的高MOI效應有關,這種“成團感染”策略使得病毒能在較短時間內完成更高水平的復制,對免疫系統的應答構成更大挑戰。
參考文獻:[1] He Z, Wang D, Chen J, et al. Peroxide Disinfection of Vesicle-Cloaked Murine Norovirus Clusters: Vesicle Membranes Protect Viruses from Inactivation[J]. Environmental Science & Technology, 2025, 59(13): 6488-6501.
來源:微生物安全與健康網,作者~教楊。






