一、菌落總數定義和衛生學意義
?菌落總數定義:指在一定條件下(如需氧情況、營養條件、pH、培養溫度和時間等)每克(每毫升)檢樣所生長出來的菌落數
?衛生學意義:菌落總數測定是用來判定食品被細菌污染的程度及衛生質量,它反映食品在生產過程中是否符合衛生要求,以便對被檢樣品做出適當的衛生學評價。菌落總數的多少在一定程度上標志著食品衛生質量的優劣。
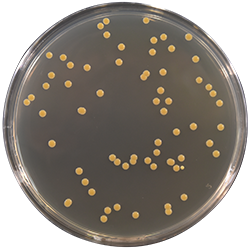
二、新標準概況
2022年06月30日發布 2022年12月30日實施
 | 本標準與GB4789.2—2016相比,主要變化如下: —— 增加了附錄B(菌落總數結果不同情況計算方法示例); —— 修改了設備和材料; —— 修改了培養基和試劑; —— 修改了檢驗程序; —— 修改了操作步驟; —— 修改了附錄 A(pca配方標注主要營養成分)。 |
三、修訂亮點
修訂亮點:“增加菌落總數測試片”

四、HandyPlate測試片的質量控制
HandyPlate測試片質量控制標準依據
?GB4789.28-2013 食品微生物學檢驗 培養基和試劑的質量要求

測試片使用步驟:
1、制備適宜濃度的測試菌液(可按GB4789.28自己制備,也可采用商品的定量菌株)

2、取1ml接種待測試測試菌片,另取1ml測試菌液傾注參比培養基TSA,按GB4789.28-2013附錄D中平板計數瓊脂(PCA)對應的質量控制標準上的培養條件進行。

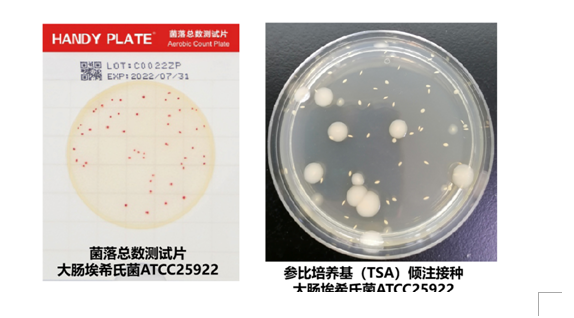
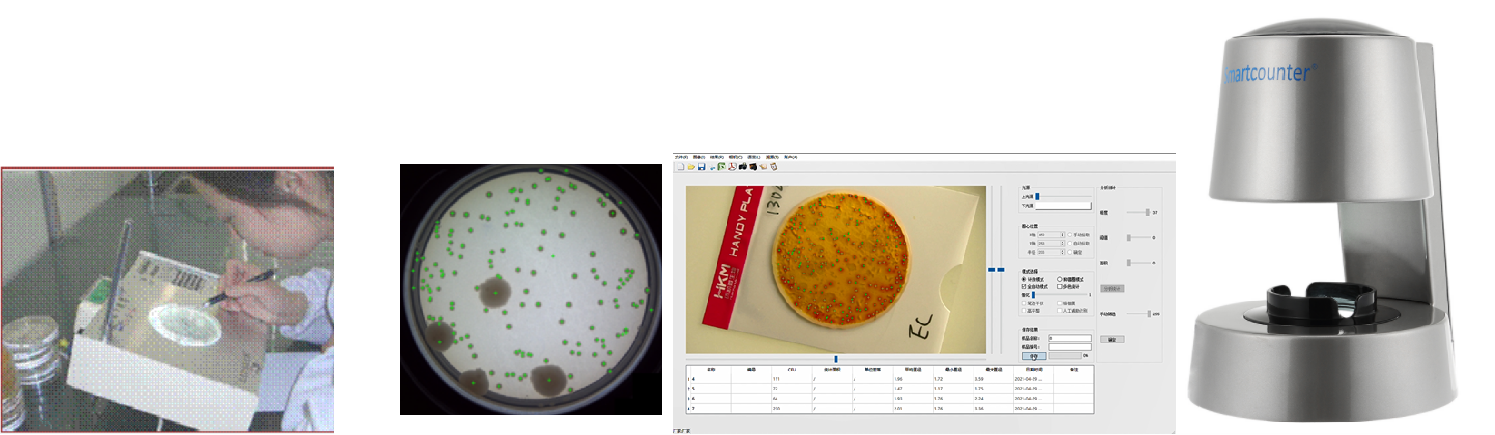
3、計數待測測試片上和參比培養基TSA上的菌落數(下圖為測試菌大腸埃希氏菌ATCC25922在菌落總數測試片和參比培養基上生長的結果)
選擇菌落數適中的平板進行計數,按下列式(1)計算生長率。

式中:
PR——生長率;
NS——待測培養基平板上得到的菌落總數;
N0——參比培養基平板上獲得的菌落總數。
參比培養基的選擇:一般細菌采用TSA,一般霉菌和酵母采用沙氏葡萄糖瓊脂,對營養有特殊要求的微生物采用適合其生長的不含抑菌劑或抗生素的培養基。
5、結果判定
依據GB4789.28-2013附錄D中平板計數瓊脂(PCA)對應的質量控制標準上質控評定標準各測試菌的生長率≥0.7,如測試的測試片各測試菌生長率≥0.7,則報告檢驗合格,否則,為不合格。
五、其他變更情況
其他一般修訂內容:
| 2022版 | 2016版 | |
| 設備和材料 | 恒溫裝置:48℃±2℃ | 恒溫水浴箱: 46 ℃±1 ℃ |
| 培養基和試劑 | 4.3 無菌磷酸鹽緩沖液 4.4 無菌生理鹽水 | 4.2 磷酸鹽緩沖液 4.3 生理鹽水 |
| 檢驗程序/操作步驟 | 6.1.2 液體樣品稀釋補充“或放入盛有225ml稀釋液的無菌均質 袋中,用拍擊式均質器拍打1min~2min,制成1:10的樣品勻液” 6.1.5選擇1~3個適宜稀釋度的樣品勻液,各取1mL分別加入無菌培養皿內 6.1.6 及時將15mL~20mL冷卻至46℃~50℃的平板計數瓊脂培養基(可放置于48℃±2℃恒溫 裝置中保溫)傾注培養皿,并轉動培養皿使其混合均勻。 | / 2-3個適宜稀釋度 及時將15mL~20mL冷卻至46 ℃的平板計數瓊脂培養基(可放置于46 ℃±1 ℃恒溫水浴箱 中保溫)傾注平皿,并轉動平皿使其混合均勻。 |
| 菌落計數 | / | 每個稀釋度的菌落數應采用兩個平板的 平均數。 |
| 菌落總數的報告 | / | 若所有平板上為蔓延菌落而無法計數,則報告菌落蔓延 |
| 附錄B | 新增:菌落總數結果不同情況計算方法示例” | / |
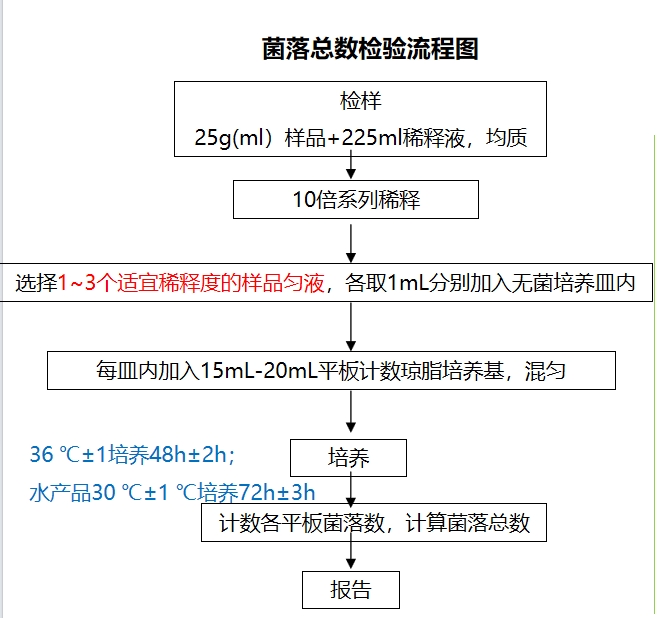
六、操作流程及注意事項
菌落總數檢驗流程圖
操作注意事項
1:從樣品的均質到傾注瓊脂,應在盡快完成,避免影響結果;
2:檢驗所用物品需無菌和無殘留的抑菌物質;
3:建議用磷酸鹽緩沖液作為稀釋液,因為磷酸鹽緩沖液能更好地糾正食品樣品中pH變化,對細菌具有保護作用;
4:高壓滅菌后,培養基的瓊脂會分層在底部,應搖勻后使用;
5:在培養箱中倒置培養,為防止中間平皿過熱,高度不得超過6個平皿。測試片堆疊不超20片
七、結果計算
1. 結果計數
?可用肉眼觀察,必要時用放大鏡或菌落計數器,記錄稀釋倍數和相應的菌落數量。菌落計數以菌落形成單位(colony-formingunits,CFU)表示。

?選取菌落數在30CFU~300CFU之間、無蔓延菌落生長的平板計數菌落總數。低于30CFU的平板記錄具體菌落數,大于300CFU的可記錄為多不可計。每個稀釋度的菌落數應采用兩個平板的平均數。
?其中一個平板有較大片狀菌落生長時,則不宜采用,而應以無片狀菌落生長的平板作為該稀釋度的菌落數;若片狀菌落不到平板的一半,而其余一半中菌落分布又很均勻,即可計算半個平板后乘以2,代表一個平板菌落數。
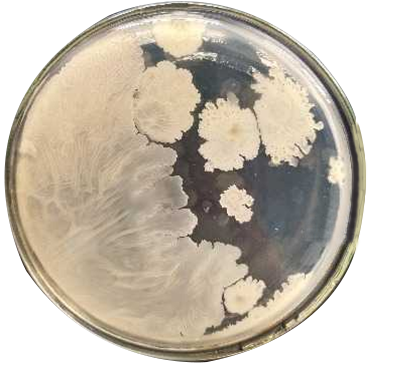
?當平板上出現菌落間無明顯界線的鏈狀生長勢,則將每條單鏈作為一個菌落計數。
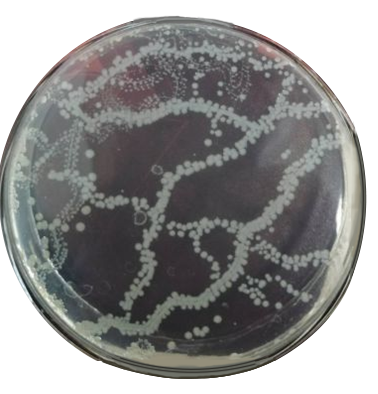
2. 結果計算

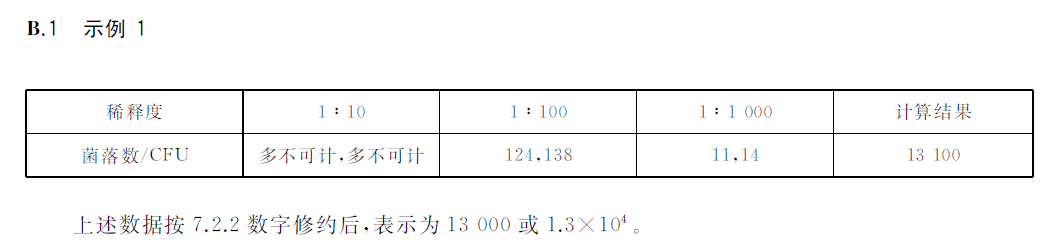
?若只有一個稀釋度平板上的菌落數在30~300CFU之間,計算兩個平板菌落數的平均值,再將平均值乘以相應稀釋倍數,作為每g(mL)樣品中菌落總數結果,示例B1。
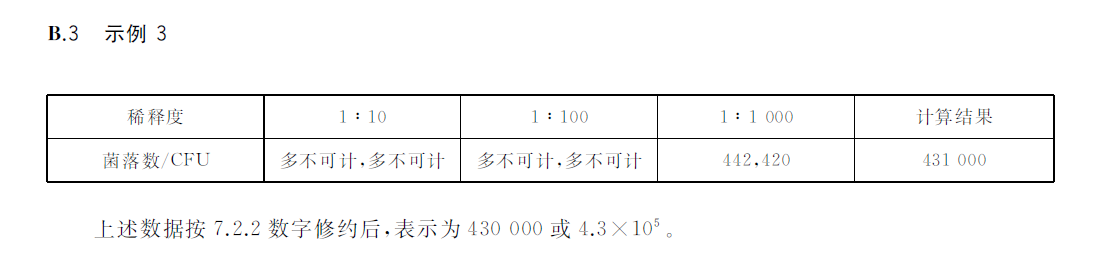
?若所有稀釋度的平板上菌落數均大于300CFU,則對稀釋度最高的平板進行計數,其他平板可記錄為多不可計,結果按平均菌落數乘以最高稀釋倍數計算,示例B3。
?若所有稀釋度的平板菌落數均小于30CFU,則應按稀釋度最低的平均菌落數乘以稀釋倍數計算,示例B4。

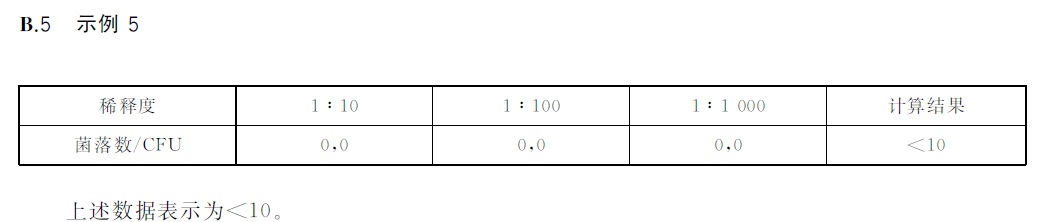
?若所有稀釋度(包括液體樣品原液)平板均無菌落生長,則以小于1乘以最低稀釋倍數計算,示例B5。
?若所有稀釋度的平板菌落數均不在30CFU~300CFU 之間,其中一部分小于30CFU 或大于300CFU 時,則以最接近30CFU 或300CFU 的平均菌落數乘以稀釋倍數計算,示例B6。

?若有兩個連續稀釋度的平板菌落數在適宜計數范圍內時,按式(1)計算,示例B2
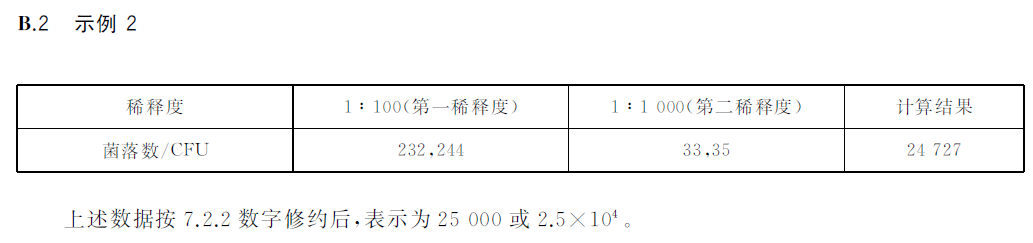
表1 菌落總數結果計算與報告方式實例
編號 | 稀釋倍數及菌落數 | |||||||
10-1 | 10-2 | 10-3 | 菌落總數 | 報告方式 | ||||
平皿1 | 平皿2 | 平皿1 | 平皿2 | 平皿1 | 平皿2 | (CFU/g或ml) | (CFU/g或ml) | |
1 | 0 | 0 | 0 | 0 | 0 | 0 | ﹤1×10 | ﹤10 |
2 | 24 | 26 | 5 | 7 | 0 | 0 | 250 | 250或2.5×102 |
3 | 多不可計 | 多不可計 | 150 | 160 | 15 | 20 | 15500 | 16000或1.6×104 |
4 | 多不可計 | 多不可計 | 236 | 245 | 35 | 33 | 24955 | 25000或2.5×104 |
5 | 多不可計 | 多不可計 | 236 | 245 | 25 | 33 | 24476 | 24000或2.4×104 |
6 | 多不可計 | 多不可計 | 多不可計 | 多不可計 | 320 | 330 | 325000 | 330000或3.3×105 |
7 | 多不可計 | 多不可計 | 310 | 320 | 28 | 26 | 27000 | 27000或2.7×104 |
8 | 多不可計 | 多不可計 | 295 | 325 | 22 | 20 | 29500 | 30000或3.0×104 |
9 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 | 菌落蔓延 |
3. 結果報告
?菌落數小于100CFU 時,按“四舍五入”原則修約,以整數報告。
?菌落數大于或等于100CFU 時,第3位數字采用“四舍五入”原則修約后,取前2位數字,后面用0代替位數;也可用10的指數形式來表示,按“四舍五入”原則修約后,采用兩位有效數字。
?若所有平板上為蔓延菌落而無法計數,則報告菌落蔓延。(已刪除)
?若空白對照上有菌落生長,則此次檢測結果無效。
?稱重取樣以CFU/g為單位報告,體積取樣以CFU/mL為單位報告。
八、質量控制和疑難解析
1. 樣品處理時是否需調節pH?
答:菌落總數大部分細菌都是嗜中性的,在偏酸偏堿的環境中都不適宜生長,如果樣品本身偏酸或偏堿,那接種后會改變平板瓊脂培養基的pH,從而影響樣品中大多數微生物的生長,影響檢測結果的準確性。
2. 菌落蔓延怎么辦?
答:首先需分析菌落蔓延的原因,一可能是樣品中含有運動性強的細菌如:變形桿菌、芽孢桿菌等,二可能是傾注時瓊脂培養基溫度高,形成較多冷凝水,三可能是培養時沒有倒置,冷凝水滴落所致。
解決辦法:一、注意傾注培養基溫度控制在40-45度之間,避免冷凝水形成;二、培養時需倒置;三覆蓋一層培養基;四在培養基中添加ttc0.5%,三 、使用菌落總數測試片。
3. 菌落總數計數同一個稀釋度一個在計數范圍,一個不在計數范圍,怎么計?
答:以在計數范圍的平板菌落數乘以稀釋倍數作為報告結果。例如:某樣品10-1平板菌落數分別320、288,10-2稀釋度平板菌落數26、20,則樣品檢測結果選取288進行報告,結果報告為2.9×10的3次方。
4. 平行兩個板結果相差較大?
答:可能是樣液未完全混勻,導致菌落分布不均勻;或者取樣偏差較大,注意校準取樣器具和取樣操作細節。平板間、稀釋度間菌落數誤差率不宜超10%。
5. 低稀釋度平板菌落數少于高稀釋度平板菌落數的原因是?
答:一產品中含防腐劑或抑菌成分,二產品偏酸或偏堿。
6. 做菌落總數檢測時,沒有菌落是怎么回事?
答:一可能是樣品經過滅菌處理,本身就沒有菌;二是檢測選擇的稀釋度過高;三樣品含抑菌成分未做去干擾處理;四傾注培養基溫度高或者培養條件不適宜等等。
7. 菌落總數的單位CFU與個有什么區別?
答:CFU是菌落形成單位,單不等于細菌個數,如兩個相同的細菌細胞連在一起,那經過培養后這兩個細菌細胞將會形成一個菌落。
8. 如何保證檢測結果的有效性?
答:一檢測過程需做空白對照,避免外源污染物影響;二檢驗用培養基使用前需進行質量確認;三檢驗過程所用器具經檢定,操作規范減少誤差。

Q-Strain定量質控菌株
九、所需培養基試劑和質控菌株
用途 | 貨號 | 名稱 | 規格 |
樣品稀釋 | CP0630 | 生理鹽水 | 盒(袋裝)225 mL×10袋 |
CP0511A | 磷酸鹽緩沖液(PBS) | 盒(瓶裝)225 mL×6瓶 | |
CP0640 | 磷酸鹽緩沖液(PBS) | 盒(袋裝)225 mL×10袋 | |
022117 | 磷酸鹽緩沖液(PBS) | 瓶(干粉)250 g | |
CP0310 | 生理鹽水 | 盒(管裝)9 mL×20支 | |
平板計數 | 022070 | 平板計數瓊脂(PCA) | 瓶(干粉)250 g |
CP0830 | 平板計數瓊脂平板(PCA) | 盒(平板)90 mm×20 | |
022070P1 | 平板計數瓊脂(PCA) | 瓶(顆粒)250 g | |
HANDYPLATE微生物測試片 | HP001 | 菌落總數測試片 | 20片/包 |
Q-Strain定量質控菌株 | QS011A | 大腸埃希氏菌(ATCC25922) | 110-1100 CFU/瓶 |
QS011B | 大腸埃希氏菌(ATCC25922) | (0.6-2.0)×107 CFU/瓶 | |
QS008A | 金黃色葡萄球菌(ATCC6538) | 110-1100 CFU/瓶 | |
QS008B | 金黃色葡萄球菌(ATCC6538) | (0.6-2.0)×107 CFU/瓶 | |
QS004A | 枯草芽孢桿菌(CMCC(B) 63501) | 110-1100 CFU/瓶 | |
QS004B | 枯草芽孢桿菌(CMCC(B) 63501) | (0.6-2.0)×107 CFU/瓶 |
手機掃碼收藏,查看更方便









